近日,《通訊醫學》發佈了一篇名爲《早期大流行性HIV-1整合位點偏好因解剖部位而異》的文章。
這項研究揭示了HIV如何在不同組織中以不同方式“藏身”,並非隨機整合入人體DNA,而是根據所在環境選擇潛伏位置。研究人員利用上世紀HIV/AIDS疫情早期的珍貴組織樣本,首次在多個器官中觀察到病毒的自然分佈,發現它會因組織差異而調整潛伏策略。
這一發現不僅幫助解釋了HIV長期難以根除的原因,也爲未來開發能精準清除或“沉默”潛伏病毒的治療方法提供了新思路。
病毒如何嵌入宿主DNA?
艾滋病病毒(HIV)之所以難以徹底根除,癥結在於其高超的“潛伏”能力。即使現代抗逆轉錄病毒藥物(ART)能有效抑制病毒,一旦患者停藥,休眠的病毒就可能迅速復甦。
近日,一項由加拿大西安大略大學和卡爾加里大學研究人員主導的最新研究,揭示了HIV病毒潛伏的核心祕密:它在人體的不同組織中,會採取截然不同的“安營紮寨”策略。這一發現,被視爲未來開發靶向療法、徹底清除病毒的關鍵一步。
在潛伏期,HIV會變成休眠的“前病毒”(provirus),將自己的基因組永久性地嵌入宿主細胞的DNA中。這些深藏不露的病毒“殘跡”是目前ART藥物無法觸及的,迫使患者不得不終身服藥。
此前的研究已確認,病毒可以潛伏在多種組織和細胞類型中,包括血液中的輔助性T細胞、腸道,甚至是大腦。但科學家一直不明白,病毒是如何在如此多樣化的環境中立足的。
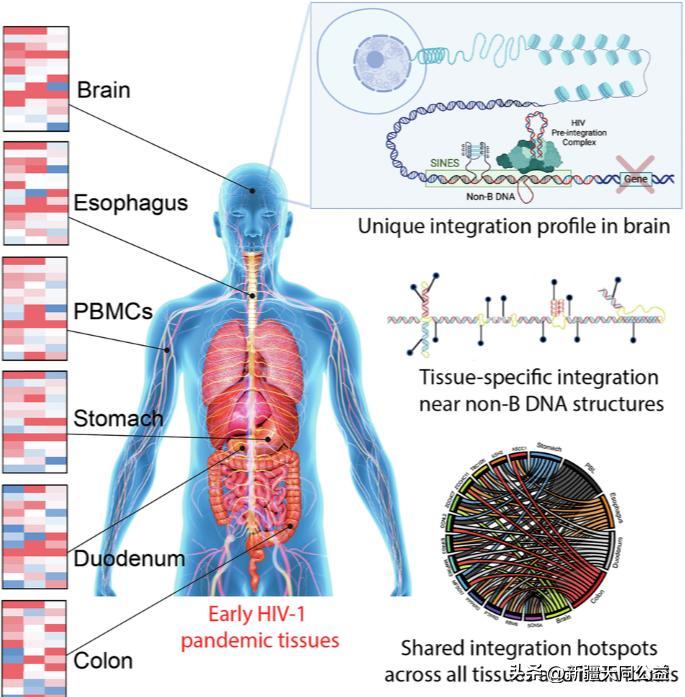
這項發表在《通訊醫學》(CommunicationsMedicine)雜誌上的研究,通過分析早期HIV/AIDS疫情時期收集的罕見組織樣本(包括血液、食道、胃、十二指腸、結腸和大腦),發現病毒的整合模式並非隨機,而是高度組織特異性。

大腦區域潛伏模式大不同
研究人員對病毒整合入宿主基因組的頻率進行了詳細分析,發現不同組織間的整合模式存在顯著差異:
大腦的獨特策略:在大腦組織中,HIV表現出明顯的“避開活躍區”的傾向。病毒更少整合到活躍的基因區域中,而是更頻繁地藏匿在相對沉寂的重複元件(SINEs)和可接近的DNA區域(DHS)中。
科學家推測,這可能是因爲大腦細胞中缺乏指導HIV整合入活躍基因的關鍵蛋白LEDGF/p75,以及存在更多能將病毒推向不活躍區域的抗病毒蛋白APOBEC3。這種策略有助於病毒逃避免疫系統的監視和清除。
其他組織的共性:相比之下,血液和胃腸道(食道、胃、結腸等)組織雖然也有一些差異,但整體上保持了相似的整合模式,通常更偏向於活躍的基因區。

存在共享的“長期庇護所”
儘管存在組織差異,但研究也發現了一個驚人的現象:
熱點重疊:研究發現,有超過17%的病毒整合位點在不同的組織間是共享的,甚至有近19%的位點在不同的感染者個體間也是共享的。這有力地證實了HIV並非隨機整合,而是高度精準地靶向某些基因組區域。
超級熱點:一個名爲TBC1D5的基因位點,在所有受試者的組織中都出現了整合。這表明特定的基因區域可能作爲病毒的“超級庇護所”,在不同個體和組織中都非常適合病毒的長期潛伏。
疾病關聯:研究還發現,HIV整合位點常位於與癌症、心血管疾病和神經系統疾病相關的基因附近。這引發了一個重要問題:HIV的這種整合是否會通過破壞基因功能,從而導致艾滋病相關併發症的發生?
歷史樣本,未來希望
研究團隊強調,這項工作得以完成,得益於早期HIV/AIDS流行期間收集並保存的罕見組織樣本。
“這些志願者在治療有限、充滿污名和恐懼的時期願意提供樣本,展現了勇氣和遠見,”卡爾加里大學的分子病毒學家GuidovanMarle表示。
研究的另一位作者、微生物學家StephenBarr總結道:“我們的研究表明,HIV遵循各組織特有的模式,這些模式可能受到局部環境與免疫反應的影響。弄清病毒在基因組中的確切潛伏位置,有助於我們用針對性療法攻擊這些細胞和組織——無論是徹底清除它們,還是永久讓病毒保持沉默。”
這項發現爲未來的艾滋病治癒研究指明瞭方向:要徹底清除HIV,不能再將全身的病毒庫視爲一個整體,而必須針對不同組織的獨特潛伏策略,開發出“因地制宜”的靶向治療方法。
文章標題:Early pandemic HIV-1 integration site preferences differ across anatomical sites
作者:Hinissan P. Kohio, Hannah O. Ajoge, Emile A. Barua,et al.
DOI: 10.1038/s43856-025-01146-5
編譯:松鼠哥